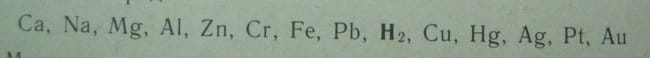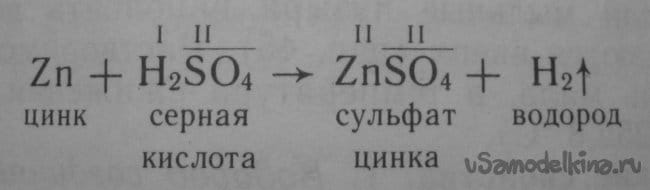Напомню, цель занятий – по возможности привить ребенку – девчонке школьнице, интерес к практическим занятиям естественных наук. Здесь, мы выполнили несколько простых опытов из начального курса школьной химии. Мы не ставили своей целью получить зрелищный результат, зато по ходу работ старались найти и правильно сформулировать каждый из физических и химических эффектов. Имея на вооружении только доступные простые реактивы из бытовых «гражданских» магазинов, даже самые простые опыты с ними в подобном ключе могут быть полезны для школьника.
Здесь, мы поставим простой опыт – вытеснение металлами водорода из кислоты, исследование некоторых его свойств. В своей домашней мастерской – импровизированной лаборатории у нас уже имеется набор пробирок в штативе. По ходу работ мы будем дооборудоваться – изготавливать и приспосабливать для своих нужд необходимые мелочи.
Что мы использовали для работы.
Лабораторная и не очень посуда, серная кислота, кусочки цинка, железа, сопутствующие мелочи.
Серная кислота – электролит из автомобильного магазина. Для удобного и относительно безопасного использования мы вполовину разбавили ее водой и подобрали удобный флакон. Флакон снабдили биркой (Фото 2).

Фото 2. Флакон для серной кислоты, емкостью около ¼ л. Бумажную бирку несколько раз обернули широким канцелярским скотчем.
Разбавлять серную кислоту следует вливая ее тонкой струйкой в воду, а не наоборот – процесс это экзотермический (с выделением теплоты) – порция воды добавленная в кислоту может вскипеть и забрызгать экспериментатора. И хотя сильный разогрев происходит при разбавлении концентрированной кислоты, правило лучше соблюдать всегда.
Взаимодействие металлов с кислотой – характерные реакции. В связи с ними стоит указать и на электрохимический ряд напряжений металлов (Фото 2).
Рис. 3. Электрохимический ряд напряжений металлов. Сейчас, нам стоит знать то, что металлы левее водорода с кислотой реагируют, причем, чем металл дальше от водорода, тем активнее идет реакция при прочих равных условиях. Металлы правее водорода в реакцию с кислотой не вступают.
Мы решили сделать опыт с двумя металлами - цинком и железом. Первая реакция – лабораторная классика, применяется как для демонстрации так и для получения более-менее ощутимых объемов водорода, например, в аппарате Киппа. Реакция с железом – удешевленный вариант, массово применяемый еще на заре эры воздухоплавания для наполнения оболочек воздушных шаров и дирижаблей. Наш цинк – недоеденные электролитом остатки стаканчика гальванического элемента (батарейки), железо – стружки или опилки от слесарных экзерсисов. Заодно и проверим не ошибся ли Н. Н. Бекетов…
К слову о воздухоплавании.
Реакция серной кислоты, а тогда ее именовали «купоросным маслом», с железом не такая уж и быстрая, да и объемы требовались изрядные. Например, профессор Жак Александр Шарль в 1783 г, для наполнения своего детища – воздушного шара диаметром 9 м, впервые наполненного водородом (а до этого их наполняли горячим воздухом), потратил около 4 дней. При этом реакция шла в 25 бочках и часть водорода профессор привез с собой в баллоне.

Рис. 4. Открытка из серии «История воздухоплавания». Худ. В. С. Любаров, «Изобразительное искусство, Москва». 1988 г.
Интересно, что остроумный и находчивый Шарль столь тщательно продумал конструкцию своего воздушного шара, что она осталась почти неизменной до сих пор. Например, это он изобрел набрасываемую на оболочку сеть для равномерного распределения нагрузки, сбрасываемый балласт, автоматическое стравливание газа через рукав снизу баллона, выпускной клапан сверху шара и управляемый из корзины, якорь для приземления.
Итак.
В две пробирки мы положили по несколько грамм каждого из выбранных нами металлов и прилили немного разбавленной кислоты. Что мы обнаружили? Железо реагирует с кислотой но не слишком интенсивно (Фото 5).

Фото 5. Реакция разбавленной серной к-ты с железом. Ни шатко ни валко – всё по тов. Бекетову (Рис. 3)
С цинком реакция идет веселее (Фото 6).

Фото 6. Реакция серной кислоты с цинком – значительно быстрее, что тоже согласуется с рядом металлов (Рис. 3).
Как можно увеличить скорость реакции? Интенсивность ее возрастет при подогреве реактора - пробирки, большем измельчении металлов (увеличении поверхности соприкосновения веществ), увеличении концентрации кислоты. Однако, концентрированная серная кислота – олеум, поверхность железа пассивирует – образует плотную нерастворимую пленку сульфата, поэтому концентрированную H2SO4 возят в стальных цистернах. Количество получаемого водорода конечно можно увеличить и экстенсивными мерами – взяв больше компонентов для реакции.
Попробуем поставить несколько опытов демонстрирующих свойства получаемого водорода.
Нам понадобится пробка с газоотводной трубкой. Мы взяли корковую пробку от винной бутылки и стеклянную «штенгельную» трубочку Ø5 мм.
Фото 7. Заготовки нашей пробки с газоотводной трубкой.
Уточнив длину трубочки по месту, отрезал кусочек стеклодувным ножом (Фото 8) и оплавил торцы в пламени газовой горелки (Фото 9).
Фото 8. Резка трубки стеклодувным ножом. Трубка прижимается к лезвию и со скрежетом проворачивается – получается незамкнутая царапина. В этом месте трубку ломают одновременно растягивая в стороны.
Фото 9. Оплавление краев трубочки. Как ни странно, тоже требует определенного навыка – постепенный нагрев, вращение. Переусердствовав можно и вовсе напрочь заплавить канал стягивающимся стеклом.
Фото 10. Пробку обрезал острым ножом подогнав к горлышку пробирки, просверлил сквозное отверстие сверлом меньшего чем трубочка диаметра, вставил трубку. Шланг мы взяли силиконовый от аквариумного компрессора, как раз налез.
Водород обычно собирают способом вытеснения воды и сжигают с характерным звуком. Нам показалось удобнее наполнить ими мыльные пузыри – с водородом внутри они всплывают вверх, к потолку, демонстрируя легкость Н2 (даже влажного – с водяным туманом), поджигать водородную пену также удобнее и безопаснее.
Мыльную пену мы приготовили в фарфоровой ступке из жидкого мыла (хорошо работает и шампунь) разбавленного водой (подобрать концентрацию) и сдобренного капелькой-другой глицерина. Для стойкости и долговечности.
В пробирку с цинком добавили реактивов и заперли пробкой с газоотводом (Фото 11).
Фото 11. Получение водородной пены.
Возможные неудачи.
Объем получаемого водорода весьма невелик и нужно набраться терпения - дождаться чтобы он заменил воздух в пробирке и шланге. До тех пор пена гореть не будет.
Из-за малого объема газа трудно и надувать возносящиеся ввысь пузыри. Пузыри при этом могут быстро лопаться – в случае бурной реакции газ содержит кислотный туман и капельки кислоты попадая изнутри на стенку мыльного пузыря «прожигают» его. Чтобы несколько осушить водород в пробирку под пробку помещают комочек стекловаты.
Фото 12. Поджигать водородную пену спичкой не особенно удобно – так и норовит прижечь пальцы. Гораздо лучше, как и рекомендуется в учебниках, лучинка – нетолстая палочка с карандаш длинной или нечто вроде каминных спичек.
Фото 13. Пузыри наполненные водородом выдуваются медленно и неохотно – мала производительность реакции.
Запишем реакцию. Здесь не повредит вспомнить о принципах их составления, валентности элементов, названиях классов веществ, названиях солей в зависимости от кислотного остатка – хлориды, нитраты, фосфаты или вот как у нас – сульфаты.
Рис. 14. Реакция цинка с серной кислотой.
Что можно сделать еще?
После окончания реакции, при избытке цинка - когда израсходуется вся кислота, в емкости останется раствор соли – сульфата цинка. Выпариванием мы можем получить его в сухом виде и использовать в дальнейших опытах. Немного раствора соли из пробирки наливаем на часовое стекло. Специального держателя у нас не нашлось, можно использовать обратный пинцет или как мы – хирургический зажим (Фото 15).
Фото 15. Выпаривание соли из водяного раствора на вогнутом «часовом» стекле.
Для нагрева мы использовали половинку таблетки сухого горючего на импровизированной подставке – чистой пустой перевернутой дном вверх консервной баночке. Выпаривать можно только водяной раствор соли, без кислоты – если реакция не закончилась, часть воды быстро испариться и станет выделяться белый едкий дым – пары серной кислоты. На всякий случай, мы рекомендуем делать опыт под вытяжкой или у открытого окна.
Выводы.
Для демонстрационных опытов с водородом – с мыльными пузырями и поджиганием пены, таки следует иметь реактор куда как более производительный, вроде помянутого тов. Киппа. При пробирочных объемах надежнее собирать водород вытеснением воды, по учебнику.
Babay Mazay, ноябрь, 2021 г.
Становитесь автором сайта, публикуйте собственные статьи, описания самоделок с оплатой за текст. Подробнее здесь.